Butane
| Butane | |||
|---|---|---|---|
| Structure et représentations du butane | |||
| Général | |||
| Nom IUPAC | butane | ||
| Synonymes | n-butane diéthyle méthyléthylméthane. |
||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES |
|
||
| InChI |
|
||
| Apparence | gaz comprimé liquefié, inodore, incolore[1]. | ||
| Propriétés chimiques | |||
| Formule brute | C4H10 [Isomères] |
||
| Masse molaire[2] | 58,1222 ± 0,0039 g·mol-1 C 82,66 %, H 17,34 %, |
||
| Propriétés physiques | |||
| T° fusion | −138,29 °C [3] | ||
| T° ébullition | −0,5 °C [3] | ||
| Solubilité | 61,2 mg·l-1 (eau, 25 °C) [4] | ||
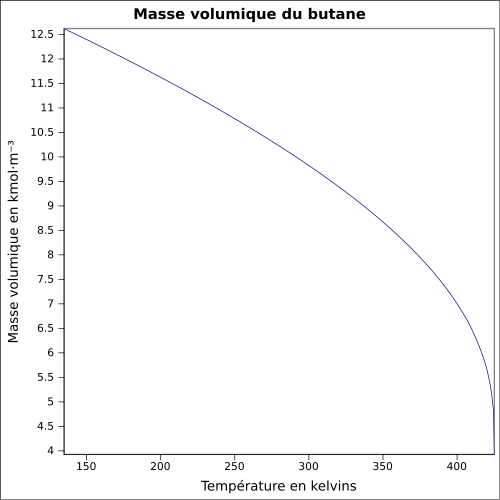
| Masse volumique | 0,6011 kg·l-1 (liquide,−0,5 °C) 2,709 kg·m-3 (gaz,25 °C, 1 013 mbar)[3] |
||
| T° d’auto-inflammation | 287 °C [1] | ||
| Point d’éclair | -60 °C [1] | ||
| Limites d’explosivité dans l’air | 1,8–8,4 %vol[1] | ||
| Pression de vapeur saturante | 2,081 bar à 20 °C 2,8 bar à 30 °C 4,9 bar à 50 °C [3] |
||
| Point critique | 151,85 °C 38,0 bar 0,255 l·mol-1 [6] |
||
| Point triple | -138,55 °C 0,007 mbar [6] |
||
| Thermochimie | |||
| S0liquide, 1 bar | 231 J·mol-1·K-1 [7] | ||
| ΔfH0gaz | -125,6 kJ·mol-1 [8] | ||
| ΔvapH° | 22,389 kJ·mol-1 à -1,1 °C [6] | ||
| Cp | 132,42 J·mol-1·K-1 (liquide,-3,15 °C) 98,49 J·mol-1·K-1 (gaz,25 °C) [6] |
||
| PCS | 49,4 MJ·kg-1 [10] | ||
| PCI | 45,6 MJ·kg-1 | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 10,53 ± 0,10 eV (gaz)[11] | ||
| Précautions | |||
|
|
|||
|
|||
|
|
|||
| Phrases R : 12, | |||
| Phrases S : 2, 9, 16, | |||
|
|
|||
|
|||
|
|
|||
|
|
|||
  |
|||
|
|
|||
  Danger Avec >0,1% de butadiène :    Danger |
|||
| Écotoxicologie | |||
| LogP | 2,89 [1] | ||
| Seuil de l’odorat | bas : 1 262 ppm haut : 5 048 ppm[16] |
||
|
|
|||
Le butane est un hydrocarbure saturé de la famille des alcanes de formule brute C4H10. Il existe sous 2 formes isomères, le butane ou n-butane et le 2-méthylpropane ou isobutane.
Sommaire |
[modifier] Utilisation
Le butane est un combustible principalement utilisé comme combustible d'appoint (chauffe-eau, barbecue,...) notamment pour les activités à l'intérieur d'un bâtiment. On peut facilement s'en procurer sous forme de bouteille.
Au niveau industriel, le butane est un réactif pour la synthèse de l'éthylène et propylène via le vapocraquage, du butadiène au moyen de la déhydrogénation catalytique et de l'anhydride maléique par le procédé de Dupont. L'oxydation non-catalytique du butane est utilisé pour la synthèse de l'acide acétique et l'isomérisation par catalyse acide permet de convertir le n-butane en isobutane[17].
Comme de nombreux hydrocarbures, le butane réagit avec le chlore pour former du 1-chloro- et du 2-chlorobutane, mais aussi d'autres composés plus substitués. Les taux de chloration peuvent partiellement s'expliquer par les différentes énergies de dissociation, 425 et 411 kJ/mole pour les 2 types de liaisons C-H (les 2 carbones centraux ont des liaisons C-H plus faibles).
[modifier] Propriétés physico-chimiques
Il est soluble dans l'alcool et l'éther, mais peu dans l'eau. Peu réactif, il nécessite un catalyseur pour participer à des réactions chimiques, sauf bien sûr pour la réaction de combustion avec le dioxygène.
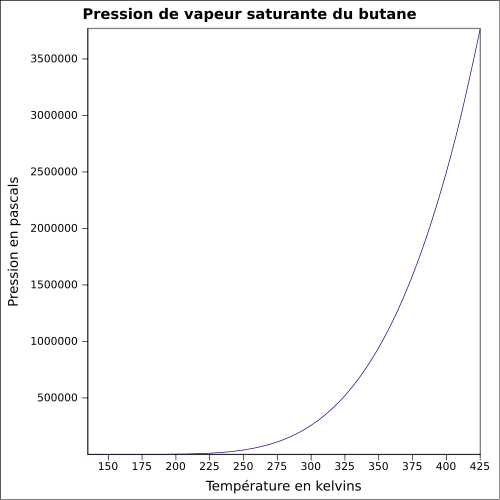
Pression de vapeur saturante[18] :
| Température | Pression | Température | Pression |
|---|---|---|---|
| -103,15 °C | 0,1 kPa | -33,15 °C | 24,1 kPa |
| -98,15 °C | 0,2 kPa | -28,15 °C | 30,9 kPa |
| -93,15 °C | 0,3 kPa | -23,15 °C | 39,1 kPa |
| -88,15 °C | 0,5 kPa | -18,15 °C | 49,1 kPa |
| -83,15 °C | 0,8 kPa | -13,15 °C | 61,0 kPa |
| -78,15 °C | 1,3 kPa | -8,15 °C | 75,0 kPa |
| -73,15 °C | 1,9 kPa | -3,15 °C | 91,5 kPa |
| -68,15 °C | 2,8 kPa | 1,85 °C | 111 kPa |
| -63,15 °C | 4,0 kPa | 6,85 °C | 133 kPa |
| -58,15 °C | 5,7 kPa | 11,85 °C | 159 kPa |
| -53,15 °C | 7,8 kPa | 16,85 °C | 188 kPa |
| -48,15 °C | 10,6 kPa | 21,85 °C | 221 kPa |
| -43,15 °C | 14,1 kPa | 26,85 °C | 258 kPa |
| -38,15 °C | 18,5 kPa | 50 °C | 490 kPa[3] |
[modifier] Production et synthèse
Le n-butane est obtenu par distillation sous pression du G.P.L (gaz de pétrole liquéfié) ainsi que par la purification du gaz naturel[17].
[modifier] Notes et références
- BUTANE (GAZ LIQUEFIE), fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk
- Entrée de « n-Butane » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 5 octobre 2009 (JavaScript nécessaire)
- ↑ BUTANE sur Hazardous Substances Data Bank. Consulté le 22 décembre 2009
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, McGraw-Hill, USA, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) « Butane » sur NIST/WebBook, consulté le 11 février 2010
- ↑ Aston, J.G.; Messerly, G.H., The heat capacity and entropy, heats of fusion and vaporization and the vapor pressure of n-butane, J. Am. Chem. Soc., 1940, 62, 1917-1923
- ↑ Pittam, D.A.; Pilcher, G., Measurements of heats of combustion by flame calorimetry. Part 8.-Methane, ethane, propane, n-butane and 2-methylpropane, J. Chem. Soc. Faraday Trans. 1, 1972, 68, 2224-2229
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Gulf Pub. Co., Huston, Texas (ISBN 0-88415-857-8)
- ↑ Les gaz Butane Propane
- ↑ (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- ↑ « butane » sur ESIS, consulté le 15 septembre 2009
- ↑ « Butane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ n-Butane sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke, Ullmann's Encyclopedia of Industrial Chemistry, Hydrocarbons, Wiley-VCH Verlag GmbH & Co, 2000
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0), p. 6-109
[modifier] Voir aussi
[modifier] Liens externes
- (en) NIST Chemistry WebBook en anglais
- Comité Français Butane Propane